导读
胃肠道包括一个复杂的生态系统,肿瘤上皮细胞与基质细胞、免疫细胞、神经元细胞、胶质细胞和其他细胞类型以及肠道内的微生物和代谢物之间有大量的功能相互作用的机会。在这篇综述中,研究者主要关注胃肠癌与中枢和肠神经系统之间的相互作用。虽然这一方面以前的研究不足,但是近些年迅速兴起的研究领域蓬勃发展,特别是对神经在食管、胃、胰腺和结肠肿瘤的发展和进展中的作用有了更好的理解。癌症神经科学为促进研究者对神经-癌症相互作用是怎样促进消化道肿瘤形成的理解提供了巨大的希望。由此产生的机制见解可用于识别诊断和预后生物标志物,并开发新的治疗干预措施。
原名:Exploiting unique features of the gut-brain interface to combat gastrointestinal cancer
译名:利用肠-脑界面的独特特征来对抗胃肠癌
期刊:The Journal of Clinical Investigation
IF:14.808
发表时间:2021.5
通讯作者:Jean-Pierre Raufman
通讯作者单位:马里兰大学医学院
人们越来越有兴趣了解神经元在非中枢神经系统癌症,特别是胃肠道癌症的发生和发展中的作用。尽管如此,癌症和神经系统之间的许多相互作用是高度依赖于环境的。因此,食管、胃、胰腺和结肠神经支配的差异会影响神经元、神经胶质细胞和癌细胞之间的串扰。肠癌与肠道微生物群和其他粪便成分以及专门的肠道免疫系统的独特接触增加了复杂性。认识到这种肿瘤微环境的重要性引起了人们对“生态疗法”的兴趣,在这种疗法中,滋养癌细胞的细胞被靶向以延缓癌症的生长。解剖特征促进了神经元、免疫细胞、肠道微生物和这一复杂生态系统的其他组成部分之间的相互作用,共同调节GI细胞的增殖、存活和侵袭(图1)。肠神经系统的神经节集中在跨越整个胃肠道长度的肌间神经丛和小肠和大肠的粘膜下神经丛。肠神经胶质细胞位于固有肌层和粘膜中,特别是在正常肠隐窝的底部。除了为神经元提供支持,数量超过神经元的肠神经胶质细胞还积极参与各种ENS功能,包括对神经元维持和存活至关重要的功能。和神经元一样,肠神经胶质表达神经递质受体和转运体,并对神经递质作出反应,主要是通过调节细胞功能的细胞内钙的变化。肠神经元和神经胶质根据它们在调节细胞结构、神经递质释放、受体激活、电生理活性和其他功能特征中的作用进行分类;单细胞测序可以修改基于分子或遗传特征的分类。图1说明了结肠癌微环境中神经-胃肠癌相互作用的广泛框架——食道癌、胃癌和胰腺癌共有的特征(表1)。图2放大了胃肠道癌细胞和肠道神经/胶质细胞网络之间的关键相互作用。
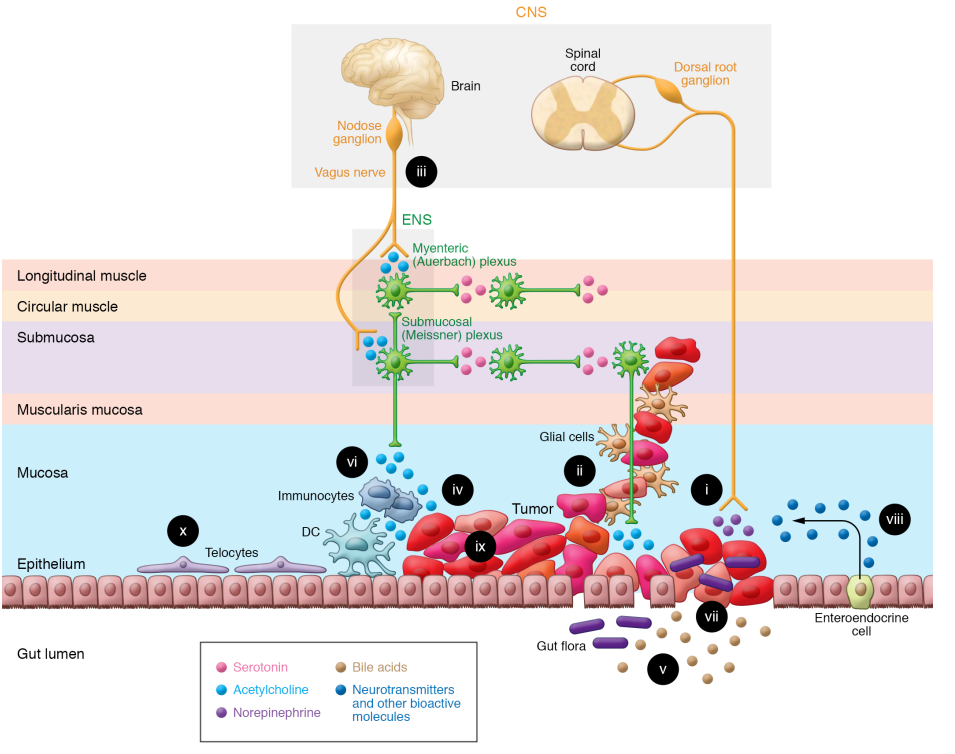
图1. GI神经元-癌症界面。肠—脑轴调节GI癌症进展的能力通过众多元素之间的邻近性性和多向串扰得到增强;这些复杂的相互作用为治疗干预提供了可能。(i)癌细胞释放神经生长因子,促进神经元趋向于肿瘤,增强对神经递质、代谢物和神经支架的获取。晚期癌症分期与增加的神经密度相关。(ii)神经周围浸润与更糟的结果相关,为肿瘤扩散、获得神经递质和保护免受免疫攻击提供了途径。(iii)迷走神经支配通过毒蕈碱机制刺激癌症进展并调节免疫功能。(iv)神经递质,如乙酰胆碱,由神经元、癌细胞、免疫细胞和可能的肠道细菌产生和释放,刺激肿瘤生长、侵袭和传播。(v) 肠道细菌修饰的排泄物胆汁酸通过多种机制调节免疫和癌细胞功能,包括激活癌细胞毒蕈碱受体。(vi)免疫细胞功能受ENS释放的神经递质以及癌症、免疫和肠内分泌细胞的调节。(vii) 癌症领域肠道屏障的破坏允许调节免疫和神经功能的微生物易位。(viii)响应细菌和神经输入,遍布粘膜的肠内分泌细胞释放神经递质和其他生物活性分子。(ix) 癌细胞显示出肿瘤内异质性并过度表达神经递质和生物活性分子的受体。(x)上皮下端细胞是肠道干细胞生态位促增殖信号的重要来源;尽管它们的位置很突出,但仍有待确定端粒细胞在神经元-癌症界面的功能作用。
表1. 胃肠道癌症共有的神经元-癌细胞相互作用的主要特征。

神经生长因子。神经生长因子或神经营养因子,包含一个高度同源的前体蛋白家族,可切割成活性肽,包括神经生长因子(NGF)、脑源性神经营养因子(BDNF)、神经胶质细胞系源性神经营养因子(GDNF)、神经营养因子-3和神经营养因子-4 (NT3和NT-4)(表2)。这些蛋白质通过多种信号机制刺激神经发育和存活;例如,神经生长因子与原肌球蛋白酪氨酸受体激酶融合蛋白的结合刺激受体同二聚化、酪氨酸激酶结构域的自磷酸化以及PI3K、Ras、磷脂酶C和其他下游效应物的激活。

注:ACh,乙酰胆碱;Atg5,自噬相关基因5;BDNF,脑源性神经营养因子;5-FU,5-氟尿嘧啶;GDNF,神经胶质细胞源性神经营养因子;HO-1,血红素加氧酶-1;M3R,M3毒蕈碱乙酰胆碱受体;NGF,神经生长因子;NT,神经营养因子;YAP,是相关蛋白。
早期癌症释放神经营养因子,刺激局部神经元生长和增加神经密度,这些特征与更具侵袭性的癌症相关。这些效应是双向的;癌症释放神经营养因子,促进神经发生、轴突生成和神经迁移,而神经元和胶质细胞释放神经递质,刺激肿瘤生长和侵袭(图2)。在PDAC的起源中对此进行了广泛的研究,其中肿瘤细胞释放神经营养生长因子(如神经生长因子)及其受体在神经元上的表达与神经密度和肿瘤侵袭性相关,这是鼠PDAC模型中神经生长因子过度表达复制的机制。在转基因小鼠PDAC模型中,手术切除腹腔和肠系膜上神经节的神经增强了化疗效果,支持了中枢神经系统输入的重要性。鼠PDAC模型强调了神经-癌症相互作用的复杂性和特异性,其中胰腺的化学去神经减轻了胰腺上皮内瘤的形成和进展,但是迷走神经切断具有相反的作用。神经侵袭和神经支架。尽管定义各不相同,神经周围侵袭(PNI)通常被定义为癌症侵入神经鞘的三层中的任何一层,或至少包围神经周长的33%的癌症;PNI影响肿瘤的生长、进展和对治疗的反应。PNI通过促进神经细胞、神经胶质细胞和肿瘤细胞之间的生物化学和物理相互作用,促进神经细胞和癌细胞的增殖,并刺激癌症沿神经平面扩散,从而促进癌症的进展。尽管PNI与所研究的任何胃肠癌的更差临床结果相关,但区域性因素(如神经密度)可能选择性地增加某些癌症相对于其他癌症的PNI重要性。尽管从癌症和免疫细胞向肿瘤微环境中释放神经生长因子和细胞因子很重要,但PNI背后的精确分子机制尚不确定。如图1所示,癌微环境中的神经元可以为GI的侵袭和转移提供物理支架;据报道,癌细胞巢位于肌间神经丛附近。癌细胞表达的关键表面分子(如L1CAM和N-钙粘蛋白)促进了肠神经元的粘附和迁移(图2)。值得注意的是,沿ENS神经元的逆行路径可能包括肠道细菌,反映了神经周围癌支架,该支架为癌细胞、神经元、胶质细胞、免疫细胞和易位微生物之间的串扰提供了中枢。很少有实验模型能够反映这种复杂的肿瘤微环境中细胞类型之间的多种相互作用。目前没有针对PNI的治疗。迷走神经支配。尽管高度依赖于环境,但迷走神经支配是CNS调节GI肿瘤的最突出方式。手术中断迷走神经(迷走神经切断术)似乎可以降低患胃癌的风险;胃神经元密度与癌症分期相关。在小鼠中,手术或药理学半切断术减弱前肿瘤Wnt信号并减少了失神经胃中胃肿瘤的形成。值得注意的是,在小鼠PDAC模型中观察到相反的效果,其中迷走神经切断术促进肿瘤形成。如下所述,这个难题可以通过M1和M3毒蕈碱受体(M1R和M3R)的差异表达来解释对癌症进展的作用相互矛盾。最后,通过逆行追踪肝迷走神经分支确定的肝-脑-肠神经弧可能调节对CRC的免疫反应。

图2. 肿瘤微环境中普通GI癌细胞和神经/胶质细胞网络之间的关键相互作用。(i) 乙酰胆碱 (ACh)的产生,由胆碱乙酰转移酶(ChAT)介导,刺激肿瘤生长、侵袭和传播。癌细胞与神经元产生的ACh的相对数量是不确定的。(ii) 从ENS中间神经元释放的血清素可能通过目前模糊的机制刺激结肠癌的生长。(iii) 从交感神经元释放的肾上腺素会刺激过度表达α-和β-肾上腺素能受体(βAR)的GI癌细胞的进展。(iv) 作为对神经递质的反应,神经胶质细胞在调节和支持神经元-癌细胞界面方面发挥着重要作用。神经胶质细胞还会产生肿瘤生长因子并将其释放到肿瘤微环境中。(v) GABA通过过度表达的GABA受体(GABAR)刺激癌细胞增殖。(vi)癌细胞释放的神经生长因子(NGF、GDNF、BDNF、神经营养因子)与神经元受体(例如NTRK)相互作用以促进轴突生长和向肿瘤的趋向性。(vii) 癌细胞表达表面分子、L1细胞粘附分子(L1CAM)和N-钙粘蛋白,促进沿着肠神经元的粘附和迁移。同质性相互作用使癌细胞上的L1CAM 粘附到神经元上表达的L1CAM。(viii) 神经元将关键代谢物(例如丝氨酸)释放到肿瘤微环境中或重新编程癌细胞代谢途径。(ix) ACh与PDAC上表达的烟碱胆碱能受体的相互作用刺激肿瘤进展。(x) 胶质细胞和GI癌细胞之间的双向相互作用涉及癌细胞衍生的白介素,其刺激前列腺素E2(PGE2)生物合成和肠神经胶质释放旁分泌。PGE2通过EP4受体介导(EP4R介导)的EGFR反式激活刺激肿瘤扩张。
癌细胞上的神经递质及其受体。几十年来,传统的神经递质,如乙酰胆碱(ACh),被认为主要来自神经元,如果不是唯一的话。在过去的15年里,人们越来越关注肿瘤微环境中的癌症和免疫细胞以及肠道微生物群中的细菌产生和释放的非神经元神经递质。在这方面,大多数研究涉及乙酰胆碱对GI表达的毒蕈碱受体的影响(图3)。人胃癌和结肠癌细胞表达胆碱乙酰转移酶(ChAT)并合成和释放ACh。正常胰腺星状细胞产生ACh,胰腺癌细胞表达胆碱转运蛋白,这是ACh产生的替代标志。然而,据作者所知,PDAC的乙酰胆碱生产尚未得到证实。释放ACh的癌细胞类型通常过表达M3R,而M3R表达与胃癌分期和转移相关。这一点及癌细胞释放的ACh浓度相对较低,表明肿瘤微环境中的癌症、簇状细胞、免疫细胞和其他细胞非神经元释放神经递质,通过自分泌和旁分泌作用调节细胞功能。与这些观察结果一致,小鼠CRC模型中的M3R缺陷减弱了瘤形成。正常肠上皮细胞中的α2A-肾上腺素能受体激活可能刺激EGFR反式激活和下游MEK/ERK信号,从而增强细胞迁移和伤口愈合。虽然肾上腺素能受体激活与PDAC进展有关,但与毒蕈碱类神经递质相比,肾上腺素能受体激动剂(如肾上腺素)在调节GI生长和进展中的作用仍相对未知。衡量神经递质(从肿瘤微环境中的神经元和癌症、免疫者、肠内分泌和其他细胞释放的)的重要性受到对极低神经递质浓度的精确空间和时间测量的挑战的限制。此外,在体外评估神经递质作用时,区分可能缺乏疾病相关性的生理学和药理学(即超生理学)神经递质浓度至关重要。
 图3. GI癌症中的毒蕈碱受体激活。(A) 胃腺癌。(i) 从迷走神经传出的ACh释放激活M3毒蕈碱受体(M3R);迷走神经切断术减轻肿瘤。(ii)癌细胞表达ChAT,这是非神经元ACh合成的关键;由此产生的ACh水平及其自分泌和旁分泌对肿瘤进展的影响仍不确定。M3R激活诱导神经生长因子(NGF) 表达。(B) PDAC。(iii)用氨甲酰甲胆碱(一种非亚型选择性毒蕈碱受体激动剂)治疗小鼠会激活毒蕈碱受体。(iv)M1R激活通过涉及抑制EGFR信号传导的未定义机制减弱PDAC进展。(C) CRC。(v) M3R信号转导EGFR;这是由MMP7介导的HB-EGF(一种EGFR配体)释放介导的。(vi) M3R和EGFR的同时激活增强了靶基因表达。(vii) M3R激活选择性地诱导MMP1、MMP7和MMP10表达。MMP1和MMP7促进细胞侵袭。MMP7还催化EGFR配体(例如HB-EGF)的释放。(viii) M1R表达和激活通过未知机制减弱结肠癌进展。(ix) 免疫细胞和(x)肠道菌群提供了额外的非神经元乙酰胆碱来源。(D) M3R后信号通过影响各种信号通路来改变基因表达和癌细胞功能。APC和/或β-catenin基因突变使β-catenin 免于蛋白酶体破坏,促进β-catenin靶基因的转录。APC和/或β-catenin基因突变使β-catenin 免于蛋白酶体破坏,促进β-catenin靶基因的转录。M3R激活可反式激活EGFR并增强β-连环蛋白信号传导。由此产生的下游基因转录变化刺激癌细胞增殖、存活、迁移、侵袭和传播。值得注意的是,神经营养因子表达的诱导可以促进神经生长和趋向性,这是一个反馈回路,提供额外的ACh和其他神经递质。
图3. GI癌症中的毒蕈碱受体激活。(A) 胃腺癌。(i) 从迷走神经传出的ACh释放激活M3毒蕈碱受体(M3R);迷走神经切断术减轻肿瘤。(ii)癌细胞表达ChAT,这是非神经元ACh合成的关键;由此产生的ACh水平及其自分泌和旁分泌对肿瘤进展的影响仍不确定。M3R激活诱导神经生长因子(NGF) 表达。(B) PDAC。(iii)用氨甲酰甲胆碱(一种非亚型选择性毒蕈碱受体激动剂)治疗小鼠会激活毒蕈碱受体。(iv)M1R激活通过涉及抑制EGFR信号传导的未定义机制减弱PDAC进展。(C) CRC。(v) M3R信号转导EGFR;这是由MMP7介导的HB-EGF(一种EGFR配体)释放介导的。(vi) M3R和EGFR的同时激活增强了靶基因表达。(vii) M3R激活选择性地诱导MMP1、MMP7和MMP10表达。MMP1和MMP7促进细胞侵袭。MMP7还催化EGFR配体(例如HB-EGF)的释放。(viii) M1R表达和激活通过未知机制减弱结肠癌进展。(ix) 免疫细胞和(x)肠道菌群提供了额外的非神经元乙酰胆碱来源。(D) M3R后信号通过影响各种信号通路来改变基因表达和癌细胞功能。APC和/或β-catenin基因突变使β-catenin 免于蛋白酶体破坏,促进β-catenin靶基因的转录。APC和/或β-catenin基因突变使β-catenin 免于蛋白酶体破坏,促进β-catenin靶基因的转录。M3R激活可反式激活EGFR并增强β-连环蛋白信号传导。由此产生的下游基因转录变化刺激癌细胞增殖、存活、迁移、侵袭和传播。值得注意的是,神经营养因子表达的诱导可以促进神经生长和趋向性,这是一个反馈回路,提供额外的ACh和其他神经递质。
胆汁酸。胆汁酸(BAs)在肝脏中产生,排泄到肠腔中,并被肠道微生物群中的细菌修饰,通过肝肠循环再循环。BA 通过与Takeda G偶联受体5(TGR5;GPBAR1)和M3毒蕈碱GPCR相互作用来调节正常和肿瘤性GI上皮细胞的功能(图3)。BA与CRC风险长期相关,具有多效作用,包括肠道免疫调节和与CRC中过度表达的毒蕈碱受体的功能相互作用。这些功能相互作用模拟胆碱能神经递质(例如 ACh)的相互作用,除其他作用外,还会导致EGFR的反式激活和刺激癌细胞增殖、存活和侵袭的信号转导。有趣的是,鹅去氧胆酸还抑制脆弱拟杆菌毒素的致癌作用。肠道免疫细胞。通过调节淋巴流量、淋巴液流出和T细胞活化,CNS肾上腺素能神经纤维抑制被神经高度支配的GI器官如胃和胰腺的免疫活动。这可能会限制免疫监视和检查点抑制剂的功效;手术或化学去神经支配可能会提高免疫治疗的疗效。ENS中的神经元还调节肠道免疫细胞的活性,这些细胞在癌症微环境中合成和释放非神经元ACh(图3)。神经内膜中的巨噬细胞释放细胞因子,通过将肿瘤细胞吸引到神经元来促进PNI。最近发现的通过肝脏连接大脑和肠道的神经弧可能通过涉及ACh神经传递的机制调节对胃肠道癌症的免疫反应。肠道微生物组。肠道屏障的破坏会促进构成肠道微生物群的细菌和真菌的透壁浸润。由宿主-肠道微生物组界面的GI上皮细胞引起的癌症打破了由正常上皮细胞之间紧密连接形成的单层屏障(图1)。癌症的“屏障破坏”效应导致的生态失调可以激活多个信号系统。例如,NF-ĸB和STAT3通路调节区域免疫细胞和神经元的功能。肿瘤会劫持这些发育、伤口愈合和抗炎信号程序来促进自身的进展。一些细菌代谢物,例如ACh和BAs,是GPCR激动剂,可以改变神经元和癌细胞的功能(图3)。CRC患者的粘膜微生物生物膜在小鼠模型中具有致癌性,一些细菌产物(例如脆弱拟杆菌毒素)有助于破坏癌症的屏障作用。肠内分泌细胞。分布在整个GI的上皮衬里(图1),在神经元、激素和旁分泌控制下的肠内分泌细胞合成并释放各种神经递质。肠内分泌细胞来源的血清素的旁分泌信号调节神经元、免疫细胞和癌细胞的活动。ENS中肠内分泌细胞或神经元释放的5-羟色胺是促进还是延缓GI癌症进展仍不确定;这可能与环境和浓度有关(图2)。与产生和释放ACh的肺上皮神经内分泌细胞类似,ACh会刺激小细胞肺癌进展,嗜铬细胞瘤等神经内分泌肿瘤可能会释放神经递质和生长因子,促进GI癌症进展。代谢分子。癌细胞具有高代谢需求且限制供血。有研究表明,在这种营养耗尽的肿瘤微环境中,神经元轴突可以为GI癌细胞提供稀缺的氨基酸和营养。Banh及其同事发现,丝氨酸剥夺会损害PDAC的生长,但允许NGF的选择性翻译和分泌增加神经密度,并为PDAC细胞提供轴突衍生的丝氨酸。Rabben等人发现胃癌是谷氨酰胺依赖性的;迷走神经切断术诱导代谢转换从谷氨酰胺分解到氧化磷酸化和糖酵解(Warburg效应)。这些研究揭示了提供神经元衍生代谢物和神经元诱导的GI癌细胞代谢重编程作为潜在治疗靶点(图2)。GI癌的器官特异性特征——食管、胃、胰腺和结肠的神经系统相互作用。在大多数情况下,区分一般性和真正的器官特异性特征有待进一步澄清。食管癌。食管癌由鳞状细胞癌和腺癌组成;腺癌的激增证明了肠-脑轴对食管癌的影响,腺癌曾经不常见,但现在是发达国家最常见的食管癌形式。胃食管反流,主要是由于对CNS(迷走神经副交感神经和脊髓交感神经)和ENS对食管下括约肌压力和食管运动的控制少,所以易患癌前巴雷特上皮和食管腺癌。因此,尽管神经元和神经胶质对食管癌进展的影响不如它们对其他胃肠道癌症进展的影响那么明显(表1),但有令人信服的证据表明神经系统在食管腺癌的发展中起着核心作用。在其他机制中,神经支配通过神经营养因子及其受体促进食管肿瘤进展(表2)。神经束和神经肽免疫反应性神经纤维表达神经营养受体激酶1(NTRK1,也称为TrkA),一种NGF结合受体,常见于过表达NGF的食管癌;一种食管癌亚型高水平表达的Trk-T1神经营养蛋白受体mRNA。在大约一半的187例食管鳞状细胞癌中检测到低亲和力p75神经营养因子受体(p75NTR),该受体在正常食管上皮细胞的干细胞群中表达。RNAi敲除食管鳞状细胞癌细胞中p75NTR表达抑制增殖并诱导凋亡。值得注意的是,在食管癌、胰腺癌和结肠癌亚组中检测到的涉及NTRK1、NTRK2或NTRK3的NTRK基因融合是FDA 批准的两种TRK抑制剂(entrectinib和larotrectinib)的靶点。PNI在大约一半的食管鳞状细胞癌中发现了一个预后更差和生存率降低的临床亚群。荟萃分析确定PNI是晚期食管和食管胃结合部癌的生物标志物。PNI与晚期TNM分期、细胞分化差、无病生存期短和局部复发率增加相关,这些因素与神经生长因子的过度表达有关。胃癌。胃的近三分之二被迷走神经广泛支配,通过胆碱能机制调节胃酸和胃蛋白酶原的分泌。流行病学观察表明胆碱能神经支配与胃肿瘤之间存在联系;神经元密度与更晚期的胃癌相关,消化性溃疡病的迷走神经切断术可能会降低长期癌症风险。这种关联的有力证据由鼠类研究提供,这些研究显示手术或药理学去神经支配后胃肿瘤减少,对化疗的反应得到改善,生存期延长,其他研究结果证实了这一点。在这些小鼠模型中,迷走神经切断术减弱了β-catenin的核转位和几种Wnt/β-catenin靶基因的表达,包括Ccnd1、Axin2、Myc、Lgr5和Cd44,为去神经支配的益处提供了一个合理的机制。至于其他胃肠道癌症,M3R缺乏或抑制表明这种受体亚型的显著作用。胃癌细胞表达ChAT,合成并释放ACh,过表达M3R(图2);M3R表达与胃癌分期和淋巴结转移相关,通过自分泌释放ACh激活M3R,通过M3R/EGFR/ERK依赖机制刺激细胞增殖;M3R敲除抑制人胃癌细胞异种移植物的生长并促进其凋亡。在小鼠胃上皮细胞中,Dclk1阳性毛簇细胞和神经元释放的ACh通过YAP介导的机制(ACh/NGF/M3R/YAP轴)诱导NGF表达,促进神经元增殖和癌症进展(图3A)。胰腺导管腺癌。神经营养因子被PDAC和胰内癌神经元过表达;添加神经营养因子以及PDAC和神经细胞的共培养会刺激PDAC细胞增殖(表2)。外源性NGF剂量依赖性地提高MMP2表达并通过激活ERK信号增强胰腺癌细胞侵袭。胰腺癌过表达GDNF,这可能对肿瘤细胞具有化学动力学影响并上调MMP9的表达和活性。MMP9是一种明胶酶(IV型胶原酶),可促进癌细胞的侵袭和转移。BDNF和NT-3也刺激PDAC侵入基底膜。腹膜后神经解剖揭示PDAC中的神经受累后,积累了强有力的证据,将神经输入与癌症进展联系起来。神经侵袭,几乎一致存在于PDAC,缩短了生存期。神经元支持和轴突引导基因突变也与PDAC进展有关。PDAC中罕见的RET突变与GDNF依赖性肿瘤侵袭相关(表2)。神经递质,如ACh、肾上腺素能激动剂、γ-氨基丁酸(GABA)和谷氨酸,从浸润 PDAC的神经元和神经胶质细胞网络释放,在肿瘤的生长和扩散中发挥重要作用。胆碱能信号通过毒蕈碱受体直接和间接抑制胰腺肿瘤发生和癌症干细胞。在基因工程小鼠中,膈下迷走神经切断术加速,毒蕈碱激动剂氨甲酰甲胆碱抑制PDAC发展;氨甲酰甲胆碱通过M1R依赖性机制提高存活率(图3B),目前正处于早期临床试验阶段。同样,在鼠PDAC模型中,膈下迷走神经切断术促进了肿瘤生长并降低了存活率,但在缺乏TNF-α的小鼠中则不然。与非神经元ACh产生一致,人和大鼠胰腺星状细胞产生的ACh可能调节胰腺外分泌和肿瘤形成。PDAC中毒蕈碱受体信号传导的特定下游靶基因仍然不确定(图3B)。β-肾上腺素能信号介导了慢性压力下观察到的加速的PDAC生长和侵袭。在 PDAC的原位小鼠模型中,体内光学成像显示压力诱导的神经激活增加了肿瘤的生长和转移。这些作用通过β-肾上腺素能信号的药理学激活重现,并被β-阻断逆转,这也延长了动物的存活期。与对照组相比,揭示了慢性压力下的PDAC小鼠具有更大的肿瘤和更短的寿命,β-受体阻滞剂的作用减弱。PDAC中的β-阻滞剂正在临床试验中进行评估。其他神经递质和受体与PDAC进展有关。例如,主要抑制CNS神经元兴奋性的GABA出人意料地刺激PDAC细胞增殖。这些作用很可能是通过过表达的GABA受体π亚基介导的,该亚基通过升高细胞内钙和激活MAPK/ERK信号传递信号。根据烟草使用者PDAC风险的增加,尼古丁衍生的亚硝胺4-(甲基亚硝胺)-1-(3-吡啶基)-1-丁酮,一种有效的诱变剂、致癌物和烟碱型乙酰胆碱受体激动剂,可诱导仓鼠的PDAC。侵袭性胰腺癌过度表达NMDA谷氨酸受体,当被谷氨酸能神经激活时,会刺激促生长信号通路。结直肠癌。CRC早期的神经影响很明显——结肠癌干细胞(CCSC)在肠神经胶质细胞网络比在正常病变和CRC更密集的环境中增殖,肠神经胶质网络表现出结构异常;S-100β和胶质纤维酸性蛋白免疫染色显示更密集和更多分支的网络以及与CRC细胞和相邻神经元密切相关的胶质细胞(图1和2)。神经胶质细胞和CRC细胞之间的双向相互作用涉及CRC衍生的IL-1α/β刺激前列腺素E2(PGE2)生物合成和肠神经胶质细胞的旁分泌释放(图2)。PGE2通过EP4受体介导的EGFR反式激活刺激CCSC生长和扩增。IL-1激活肠神经胶质细胞可能通过对免疫细胞的影响来促进肿瘤发生,类似于炎症性肠病中会增加CRC风险的免疫细胞。在人类CRC细胞系、免疫缺陷小鼠和原代人类CRC细胞中,肠神经胶质刺激CCSC衍生肿瘤的数量和大小增加,将肠神经胶质确定为潜在的治疗靶点。神经元还通过充当CRC细胞迁移和转移的物理支架来促进肿瘤发展(图1)。ENS神经元是独特的无髓鞘;神经束膜和神经内鞘层的缺失提供了与肿瘤和神经胶质细胞无阻碍的界面,这通过旁分泌信号使CCSC激活成为可能。肠神经元和EpCAM阳性结直肠癌细胞密切相关,尤其是在肿瘤浸润前沿,促进了两种细胞类型之间的物理相互作用(图2)。细菌种类之间的协同相互作用与 CRC 的发生和进展有关;在小鼠模型中,微生物(例如脆弱拟杆菌、大肠杆菌和具核梭杆菌)释放因子,包括脆弱拟杆菌衍生的 BFT 毒素、有核梭杆菌衍生的FadA和Fap2粘附素,以及NF-κB,可增强 CRC 进展。这些因素很可能会调节ENS活动;例如,NF-κB在调节CNS炎症中起着关键作用。肠道微生物组、CRC细胞和肠道神经元之间的这些多向相互作用可能会促进癌症进展;更有力的证据等待更好的实验模型。由于结肠某一区域的免疫、上皮和神经细胞功能以及微生物多样性的差异可能会影响其他部位的癌症发展和进展,因此单纯的简化方法来探索微生物组、ENS和肿瘤形成之间的联系可能会产生误导。细胞表面分子(例如L1CAM和N-钙粘蛋白)促进了CRC细胞粘附到肠神经元并迁移到新的解剖位置的能力(图2),并且可以通过神经营养因子(例如,NT-4)进行调节(表2)。当与原代肠神经元、肠神经胶质和间充质细胞共培养时,来自已建立细胞系的CRC细胞和原代CRC细胞与肠神经元共定位。此外,与未转化的肠上皮细胞和间充质细胞相比,CRC细胞迁移更远的距离以到达肠神经元并以更大的力粘附于它们。通过胶原蛋白和基底膜的高阻力神经鞘层成功侵入CRC细胞,可识别更坚固的细胞并赋予存活和增殖优势。除了PNI的预后价值外,单细胞基因分析还可以识别预测PNI和癌症、神经元和神经胶质基因的表达模式,从而提供治疗机会。与胃癌和PDAC一样,CRC中的胆碱能毒蕈碱受体是最突出的神经递质靶标。用非亚型选择性毒蕈碱激动剂氨甲酰甲胆碱治疗可促进小鼠结肠瘤形成。在五种毒蕈碱受体亚型中,M1R和M3R活性最显着地调节结肠癌进展(图3C)。M3R在原发性CRC中的过表达可预测转移,在散发性和遗传性CRC的小鼠模型中,整体M3R缺乏可有力地减轻肠道肿瘤。M3R激活选择性地诱导MMP1、MMP7和MMP10的表达,从而促进CRC的侵袭和扩散。在体外阻断MMP1的表达和激活可以消除ACh诱导的结肠癌细胞侵入内皮细胞单层。选择性BA(例如,脱氧胆牛磺酸)可以激活M3R,提供一种机制,由此增加的排泄物BA水平会增加小鼠结肠瘤形成。M3R在GI癌症中的作用机制总结在图3D中。与M3R相比,M1R在GI癌症中的作用仍然不清楚。与PDAC的动物模型一样,在氧化偶氮甲烷治疗的小鼠中,M1R缺乏适度增加了结肠瘤形成,尤其是抵消了M3R缺失的有益影响。针对毒蕈碱受体信号传导的治疗策略可能需要同时靶向M1R和M3R。实验性地捕捉复杂的肠-脑相互作用具有挑战性。虽然简化实验系统,如细胞共培养,是解析交叉方向细胞信号的有价值的方法,但它们无法捕捉活生物体中复杂的环境和细胞间的相互作用。这些模型可能无法准确反映神经递质和其他生物活性分子的相关浓度、细胞外空间的扩散极限以及其他对区分生理和药理作用很重要的参数(表3)。人类胃肠道具有特别复杂和动态的生态系统,即使是体内小鼠和其他动物模型也可能无法复制,这些动物模型也受到物种差异的干扰(图1
)
。表3. 评估GI神经-癌症相互作用的实验模型的优点和局限性。
 注:AOM,氧化偶氮甲烷;DSS,葡聚糖硫酸钠;FFPE,福尔马林固定石蜡包埋;KC, (LSL -Kras+/LSL -G12D Pdx1-Cre);KPC,(LSL-Kras+/LSL -G12D LSL Trp53+/R172H Pdx1-Cre)。
注:AOM,氧化偶氮甲烷;DSS,葡聚糖硫酸钠;FFPE,福尔马林固定石蜡包埋;KC, (LSL -Kras+/LSL -G12D Pdx1-Cre);KPC,(LSL-Kras+/LSL -G12D LSL Trp53+/R172H Pdx1-Cre)。
技术限制和对质量控制的关注不足—例如,确认抗体的特异性,特别是针对GPCR的抗体;验证细胞系和转基因小鼠;优化组织固定、保存和自发荧光;并确保高质量的mRNA测量—进一步影响数据质量、解释和翻译价值。另一个挑战是在体外、离体和体内复制癌细胞对PNI和沿神经支架迁移的物理力(图1)。总的来说,这些限制导致了实验模型在预测临床试验中新型干预措施的治疗成功方面的不良记录,以及针对肠脑轴的治疗缺乏。体外模型。大多数关于神经递质对致癌细胞信号传导和功能影响的信息来自体外细胞模型。这些使用相对较少的人类癌细胞系库,其中许多是在几十年前建立的。广泛的传代很可能改变了他们的基因组成和关键的生物学特征。使用原代胃肠道癌细胞可以解决这些问题,但受到不断补充组织样本和癌症先天异质性的限制。共培养原发性GI癌症和ENS细胞提供了有用的信息,但不能完全捕获复杂的体内细胞相互作用。生物医学期刊通常要求研究人员在多种癌细胞系中复制研究结果,但对这一指导的遵守情况并不统一;就在2018年,一项其他示例性研究仅使用了一种已建立的人类结肠癌细胞系,但没有提供细胞系选择的基本原理,尽管关键发现在原代人类结肠癌细胞中得到了复制。即使使用多个细胞系也不能保证在更复杂的系统中的科学有效性或可重复性,特别是考虑到缺乏来自肿瘤微环境的神经和神经胶质成分的交叉输入以及大量的肿瘤内和神经网络多样性。在某种程度上,单细胞RNA测序的使用可能会解决后一种限制,但必须通过定量PCR确认的基因表达变化不一定反映在蛋白质表达的相应变化中。离体模型。从GI癌症干细胞开发的常规类器官模型可以提供有关促进生长、侵袭和转移的因素的有用信息,但除其他限制外,类器官缺乏神经和免疫元素。即使是允许在模拟基底膜的支架上生长小肠的新型3D类器官芯片,也未能结合神经元件。这些限制可以通过组织工程来克服,以从更忠实地模拟体内生物学的组织干细胞开发支架引导的类器官形态发生。除了进一步研究神经元在胃肠道肿瘤中的作用外,越来越准确的患者衍生类器官模型的开发可能会通过预测针对肠脑轴的新型疗法的疗效,为精准医学的进步铺平道路。体内模型。由注射到免疫缺陷小鼠皮肤中的人类癌细胞开发的异种移植物是常见的“体内”模型。更讽刺的是,这些模型仅代表了从体外溶液到活生物体的培养基变化;异种移植实验几乎一致地反映了体外研究结果,而没有提供新的机制见解,仅提供体外研究结果的增量进展和有限验证。原位异种移植物可以更忠实地复制人类癌症的进展和转移,例如,植入小鼠乙状结肠的人类结肠癌细胞。患者来源的异种移植物(PDX)可以提供实时信息以开发癌症特异性治疗。体内模型通常无法解释人类免疫和神经细胞对胃肠道癌症进展的影响,即使PDX模型采用“人性化”小鼠。肠道微生物群的变异也会混淆结果;应避免仅基于小鼠研究的因果推断。使用人体手术组织的研究人员通常使用邻近的未受累组织作为对照,但即使使用距离癌症10 cm或更宽的边缘,也可能会被肉眼无法区分的癌症“场效应”影响“对照”细胞。构成理解神经-肿瘤相互作用基础的神经支配图主要来自对非癌组织的研究,而GI癌症可能会重组和重新连接神经元网络。手术操作的脱靶效应,例如迷走神经切断术,可能会以意想不到的方式改变GI癌症-神经元界面。基因工程小鼠和猪在生理和病理生理学上受到基本物种差异的限制。例如,小鼠和人类的免疫系统具有非常不同的主要组织相容性基因。人源化基因工程小鼠模型潜伏期长,不能重现晚期人类疾病,这是最困难的临床管理问题。即使结合先进的技术和模型,也无法忠实地模拟人类GI肿瘤微环境的复杂性。尽管取得了令人瞩目的进展,但针对GI癌症肠-脑轴的治疗干预目前仅限于靶向神经营养因子、毒蕈碱和β-肾上腺素能受体。为了推进该领域,需要更全面地了解GI神经元-神经胶质-癌细胞界面,类似于肠道微生物组和免疫系统。适合探索的特定领域包括(a)确定胃肠道肿瘤分泌组的癌前变化如何改变肠神经胶质网络并促进肿瘤发生;(b)使用单细胞RNA-Seq和空间转录组学来开发更完整的细胞、基因和蛋白质清单,这些细胞、基因和蛋白质包含肿瘤-神经元粘附复合物和分子指导因子,并更好地了解它们的表达如何改变癌症进展;(c)使用类似的方法来了解免疫细胞(例如肿瘤相关巨噬细胞)如何介导ENS和GI癌细胞之间的相互作用;(d)阐明GI癌症如何吸引神经元和 ENS 的其他成分,反之亦然;(e)探索像L1CAM这样的分子,其表达与PDAC中的PNI相关,是否是可行的治疗靶点;(f)研究PNI是否为胃肠癌细胞提供逃避免疫检测和治疗的机制;(g)对增强癌细胞存活和生长的轴突衍生代谢物进行编目;(h)改进实验模型,以更忠实地捕捉GI肿瘤微环境的非凡复杂性以及神经和神经胶质网络的整合。利用组织制备、清除和更高分辨率光学成像方面的进步来解析CNS和ENS路径,将带来GI癌症神经科学中令人兴奋的研究机会;用于单细胞mRNA测序和代谢组学的计算生物学;光遗传学利用光来监测和控制单个神经元的活动以及通过基因编辑修改的生化途径;3D电生理记录;和人工智能。整合新发现的细胞类型和信号通路将产生新的机制见解和治疗目标。例如,上皮下端细胞为整个小肠和结肠的干细胞提供促增殖信号,可能有助于结肠癌干细胞与肿瘤微环境成分之间的串扰(图1)。填补知识中的关键空白具有巨大的潜力,可以促进我们对肠脑轴在胃肠道癌症进展中的作用的理解,并使我们能够利用这些信息来改善治疗结果。由于共享途径和机制(图2和图3D),针对一种胃肠道癌症的肠脑连接的新型疗法可能适用于其他癌症。









